一、基础
海因里希·鲁道夫·赫兹和菲利普·莱纳德等人在实验中发现,光照可以从金属中打出电子来。同时他们可以测量这些电子的动能。不论入射光的强度,只有当光的频率,超过一个临限值后,才会有电子被射出。此后被打出的电子的动能,随光的频率线性升高,而光的强度仅决定射出的电子的数量。爱因斯坦提出了光的量子(光子这个名称后来才出现)的理论,来解释这个现象。光的量子的能量为

在光电效应中,这个能量被电子获得,其中一部分被用来将金属中的电子射出(这部分能量叫功函数,用那个 表示),另一部分被用来加速已经脱离金属电子(这部分能量转化为电子的动能):
表示),另一部分被用来加速已经脱离金属电子(这部分能量转化为电子的动能):

这里 是电子的质量,
是电子的质量, 是其速度。假如光的频率太小的话,那么它无法使得电子获得足够的逸出功。这时,不论光强有多大,照射时间有多长,都不会发生光电效应。而当入射光的频率高于极限频率时,即使光不够强,当它射到金属表面时也会观察到光电子发射。
是其速度。假如光的频率太小的话,那么它无法使得电子获得足够的逸出功。这时,不论光强有多大,照射时间有多长,都不会发生光电效应。而当入射光的频率高于极限频率时,即使光不够强,当它射到金属表面时也会观察到光电子发射。
20世纪初,卢瑟福模型在当时被认为是正确的原子模型。这个模型假设带负电荷的电子,像行星围绕太阳运转一样,围绕带正电荷的原子核运转。在这个过程中库仑力与离心力必须平衡。
但是这个模型有两个问题无法解决。首先,按照经典电磁学,这个模型不稳定。按照电磁学,电子不断地在它的运转过程中被加速,同时应该通过放射电磁波丧失其能量,这样它很快就会坠入原子核。其次,实验结果显示,原子的发射光谱由一系列离散的发射线组成,比如氢原子的发射光谱由一个紫外线系列(来曼系)、一个可见光系列(巴耳麦系)和其它的红外线系列组成。按照经典理论原子的发射谱应该是连续的。
1913年,尼尔斯·玻尔提出了以他名字命名的玻尔模型,这个模型为原子结构和光谱线,给出了一个理论原理。玻尔认为,电子只能在对应某些特定能量值 的轨道上运转。假如一个电子,从一个能量比较高的轨道(
的轨道上运转。假如一个电子,从一个能量比较高的轨道( ),跃到一个能量比较低的轨道(
),跃到一个能量比较低的轨道(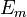 )上时,它发射的光的频率为
)上时,它发射的光的频率为
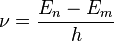
反之,电子通过吸收同样频率的光子,可以从低能的轨道,跃到高能的轨道上。
玻尔模型可以解释氢原子的结构。
因此电子之间的衍射可以被排除。显然电子同时通过了两个缝,相互之间发生了衍射,从而导致了这个结果。对于经典物理学来说,这个解释非常奇怪。从量子力学的角度来看,电子的分布概率和衍射结果均可以通过 这两个通过两个栅的、叠加在一起的状态,简易地演算出来。这个实验非常明显地显示出了波粒二象性
这两个通过两个栅的、叠加在一起的状态,简易地演算出来。这个实验非常明显地显示出了波粒二象性二、功能团
1、细胞合成的分子中含有碳,组成细胞的分子中最为重要的功能团有:
(1)-OH 羟(qiǎng)基
由氢原子和氧原子组成,氧原子一方面与氢形成单键,另一方面又与碳形成单键。
(2)>CO羰(tāng)基
一个碳原子与一个氧原子形成双键,碳原子的另外2个键可以连在另外的碳上,也可以与氢相连。
(3)-COOH羧(suō)基
碳原子一方面与氧形成双键,另一方面又连接着一个羟基
(4)-NH2氨基
由一个氮原子 和两个氢原子 组成,氮原子上的另一个键可连在碳上,起到碱的作用,能吸引H+。
含氨基的有机化合物可称为胺类
上图为甲氨
大分子分为蛋白质、核酸、多糖、脂质,其中前3种由多聚体组成,多聚体是由相同 或相似的小分子组成的长链,这种小分子称为单体,
单体都包括H和-OH,这意味多个单体可造成脱水,因为多个单体的H与-OH会合成水(H2O),而如果要分解为单体,即分解大分子,就是要加入一个水分子使分子间的化学键断裂。因为H2O会被分解并连接到被释放的单体中,是脱水的逆过程
原文:http://blog.csdn.net/wty__/article/details/20465857